Eine Autoimmunerkrankung von Johnson & Johnson, die ein relativer Nachzügler in seiner Arzneimittelklasse ist, kann nun in seiner ersten von der FDA zugelassenen Indikation mit einem Etikett konkurrieren, das eine breitere Patientenpopulation abdeckt als Produkte, die bereits von Ardenx und UCB erhältlich sind.
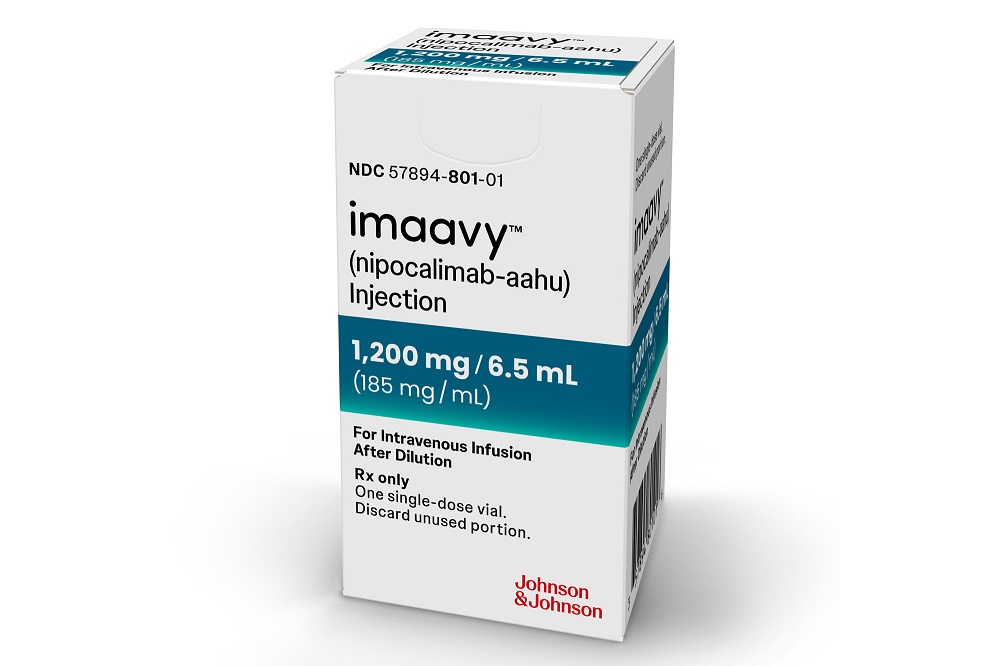
Die FDA hat das in der Entwicklung als Nipocalimab bezeichnete J & J -Medikament als Behandlung für generalisierte Myasthenia gravis (GMG) zugelassen. Die angekündigte regulatorische Entscheidung, die am Mittwoch angekündigt wurde, könnte der erste von mehreren für diesen Antikörper sein, den der pharmazeutische Riese prognostiziert hat, dass sie über mehrere Indikationen hinweg 5 Milliarden US -Dollar in Höhe von 5 Milliarden US -Dollar erreichen könnten. Das neue J & J -Produkt, das alle zwei Wochen als intravenöse Infusion verwaltet wird, wird unter dem Markennamen Imaavy vermarktet.
In GMG stellt das Immunsystem Autoantikörper her, die Proteine angreifen, die an der Kommunikation zwischen Nerven und Muskeln beteiligt sind. Patienten entwickeln schwere Muskelschwäche sowie Probleme mit dem Sprechen und Schlucken. J & J sagt, dass schätzungsweise 100.000 Menschen in den USA mit GMG leben. Es gibt weltweit etwa 700.000 Patienten.
Imaavy nutzt die eingebaute Mechanismen einer Zelle für die Behandlung von Proteinen, einschließlich Antikörpern. Proteine werden routinemäßig in Zellen gebracht, in denen sie entweder in ein zelluläres System gehen, das sie verschlechtert, oder sie werden in den Kreislauf recycelt. Antikörper, die an den Neugeborenen -FC -Rezeptor (FCRN) gebunden sind, werden recycelt. Der Antikörper in iMavy ist so konzipiert, dass er FCRN blockiert, ein Ansatz, der den Abbau von Autoantikörpern von Krankheiten erhöht. Die Zulassung in GMG umfasst Erwachsene und Kinder ab 12 Jahren, die entweder für die ACHR- oder die Musk -Autoantikörper, die die Krankheit vorantreiben, positiv sind.
In Phase 3 -Tests bei Erwachsenen berichtete J & J, dass IMAavy die Autoantikörperspiegel um bis zu 75% gegenüber der ersten Dosis verringerte. Diese Reduzierung wurde während der 24-wöchigen Studie aufrechterhalten. Die Ergebnisse wurden im Februar in der Lancet Neurology veröffentlicht.
„Patienten hatten eine wesentliche Symptomlinderung und dauerhafte Krankheitskontrolle, die zu einer besseren täglichen Funktion führten und über 24 Wochen in der zentralen Vivacity-MG3-Studie nicht über 24 Wochen verblasste“, sagte Dr. Nicholas Silvestri, Professor für Neurologie an der Universität von Buffalo, in der Erklärung von J & J in der Ankündigung der Zulassung einbezogen. „Eine Behandlung, die dieses Maß an dauerhafter Symptomstabilität liefert, ist ein sinnvoller Schritt nach vorne für die Behandlung einer komplexen und unvorhersehbaren Krankheit wie GMG und es sowohl bei AChR+ als auch bei MUSK+ Erwachsenen und pädiatrischen Patienten ab 12 Jahren eine zusätzliche FCRN -Behandlung in einen breiteren Bereich von Patienten verleiht.“
In der Phase 2/3 Test von IMAVY bei pädiatrischen Patienten, die noch andauern, hat J & J über 24 Wochen über eine Reduzierung von Autoantikörpern von Krankheiten um 69% gemeldet. Die Fähigkeit zur Behandlung von pädiatrischen GMG -Patienten unterscheidet IMAAVY von seinen Konkurrenten.
Ardenx ‚Vyvgart, das 2021 von der FDA zugelassen wurde, war das erste FCRN-blockierte Medikament, das GMG-Patienten erreichte. Dieses Antikörperfragment befasst sich nur mit Krankheiten, die durch AChR -Autoantikörper angetrieben werden. Die Agentur hat im Jahr 2023 eine subkutan injizierbare Version des Arzneimittels, Vyvgart Hytrulo, abgemeldet. Beide Produkte sind nur für die Verwendung bei Erwachsenen zugelassen.
UCB vermarktet einen von der FDA zugelassenen FCRN-Blocker namens Rystiggo, eine einst wöchentliche Infusion, die sowohl ACHR- als auch Musk-Antikörper befasst. Die belgische Firma hat ein weiteres von der FDA genehmigter GMG-Medikament, Zilbrysq. Dieses Arzneimittel blockiert ein Komplementsystemprotein, das die Krankheit fördert, und seine Zulassung in GMG deckt nur Patienten mit positiven ACHR -Antikörpern ab. Die Genehmigungen 2023 beider UCB -Produkte ermöglichen ihre Verwendung nur bei Erwachsenen.
Imaavy war das Hauptvermögen von Impuls Pharmaceuticals, das J & J im Jahr 2020 für 6,5 Milliarden US -Dollar erwarb. Impulte entwickelte den Antikörper für mehrere Autoimmunanzeigen, und J & J setzt diese Strategie fort. Abgesehen von seltenen Autoantikörper -Störungen entwickelt J & J dieses Medikament für Alloantikörperkrankheiten der Schwangerschaft sowie gegen vorherrschende rheumatologische Störungen wie Lupus und rheumatoide Arthritis. Das Unternehmen plant derzeit 10 Indikationen für das Medikament.
Die 5 -Milliarden -Dollar -Verkaufsprojektion von J & J für IMaavy umfasst alle potenziellen Hinweise. Wenn es dem Produkt jedoch gelingt, seine zugelassenen Verwendungen zu erweitern, könnte es auch gegen die FCRN-blockierenden Medikamente von Ardenx und UCB steigen. Beide Unternehmen führen klinische Forschung durch, die die Expansion ihrer jeweiligen Produkte auf andere Indikationen unterstützen könnten. Im vergangenen Sommer genehmigte die FDA den Vyvgart Hytrulo von Ardenx als neue Behandlung für chronisch entzündliche Demyelination Polyneuropathy (CIDP). Diese seltene Krankheit, bei der Autoantikörper die Nerven angreifen, ist eine der Anzeichen dafür, dass J & J mit Imaavy verfolgt.
Foto von Johnson & Johnson